Химия и химическая технология
Построение рестрикционной карты
Построение рестрикционной карты вируса. ДНК, выделенная из вируса, инфицирующего животные клетки. имеет обычное эквивалентное соотношение оснований и устойчива ко всем известным экзонуклеазам. [c.993]
Построение рестрикционной карты [c.45]
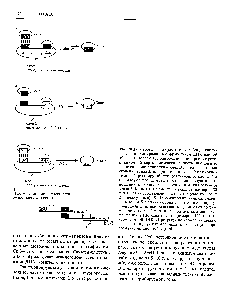
При построении рестрикционных карт обычно используют несколько рестриктаз, поэтому приходится анализировать сложные соотношения между фрагментами. полученными под действием различных ферментов. Процедуру картирования можно значительно упростить с помощью специальных приемов. [c.45]
Комбинируя методы концевой метки и неполного расщепления, можно определить расположение всех фрагментов, полученных под действием одной рестриктазы. Сочетая этот метод с методом перекрывающихся фрагментов, а также используя несколько рестриктаз, можно быть уверенным, что построенная рестрикционная карта включает всю ДНК и ни один из мелких фрагментов не потерян. [c.46]
Построение рестрикционной карты генома дает возможность разработать стратегию определения последовательности нуклеотидов в генах, представляющих особый интерес. В результате действия нескольких различных ферментов образуются сравнительно мелкие перекрывающиеся фрагменты, содержащие не более нескольких сотен нуклеотидов. Эти фрагменты могут быть выделены в чистом виде. и в них может быть установлена последовательность нуклеотидов. Затем, зная взаимно перекрывающиеся участки последовательностей, можно восстановить последовательность нуклеотидов в крупных фрагментах и в геноме в целом. [c.272]
Гибридизация по Саузерну. Гибридизация по Саузерну позволяет получить информацию о перекрывании фрагментов различных рестрикций и "обойти" этапы поиска вилок и вложений, перейдя сразу к построению рестрикционной карты по интервальному графу (разд. 5.3). Помимо это- [c.186]
Картирование генома подразумевает создание систематизированной библиотеки клонов. которая полностью представляет геном (или определенную его часть) и содержит набор генетических маркеров. достаточный, чтобы строить физическую и генетическую карты. По ходу исследований мы постепенно приближаемся к истинной структуре. В идеале карты, полученные разными способами. должны быть идентичными. Изучение структуры генома не требует обязательного построения рестрикционной карты, однако некоторые способы картирования автоматически приводят к ее получению. [c.31]
Принцип, на котором основан метод построения рестрикционных карт, очень похож на тот, который используется при химическом секвенировании ДНК. В обоих случаях молекулы метят на одном конце, затем частично фрагментируют с помощью неполного расщепления в нескольких специфических сайтах и, наконец, распределяют фрагменты по размерам. Длина меченого фрагмента указывает на расстояние от меченого конца до сайта, по которому произошло расщепление. [c.309]
Построение рестрикционной карты кольцевой молекулы ДНК длиной 12 т.п.н, ДНК гидролизовали указанными эндонуклеазами по отдельности или в разных комбинациях и определяли размер фрагментов (в т.п.н.) с помощью электрофореза в агарозном геле. Зная размер фрагментов. можно установить положение сайтов узнавания для трех представленных ферментов. [c.219]
Для определения положения сегментов в небольщих рекомбинантных геномах используются те же подходы, что и при нахождении специфических сегментов в больщих геномах до клонирования (разд. 6.Тб). После построения рестрикционной карты вставки установить точную локализацию нужного сегмента не составляет труда. Для этого нужен только подходящий меченый зонд. аналогичный ДНК- или РНК-зонду, используемому для отбора клона в начале клонирования. [c.318]
Если известна подробная рестрикционная карта клонированной последовательности, то набор линейных матриц. полученных разрезанием этой последовательности по разным сайтам. позволяет получить ряд последовательно удлиняющихся зондов. Их можно использовать для построения транскрипционной карты клонирования последовательности. [c.18]
Рис. 20.27. Прогулка по хромосоме. А. Зонд 1 гибридизуют с клонированным фрагментом ДНК длиной 40 т. п. н. После субклонирования и построения рестрикционной карты последовательность, дистальную по отношению к гибридизовавшейся, используют для создания зонда 2. Б. При помощи зонда 2 из библиотеки выбирают другой клон (отличный от клона 1) и используют последовательность, дистальную по отношению к гибридизовавшейся с ним, для создания зонда 3. Клоны 1 и 2 вместе составляют примерно 80 т. п. н. (за вычетом перекрывающегося участка - зонд

Бурное развитие молекулярной генетики человека, начавшееся в 1980-х гг. стало возможным благодаря новаторским идеям Д. Ботштейна, Р. Уайта, М. Скол-ника и С. Дэвиса. Они обратили внимание, что полиморфизм длины рестрикционных фрагментов (ПДРФ) человека порождает полиморфные аллели (маркерные локусы), поддающиеся картированию. Как писали авторы в своей статье, мы хотим предложить новый способ построения генетической карты сцепления человека. В его основе лежит создание при помоши технологии рекомбинантных ДНК случайных однокопийных ДНК-зондов, способных выявлять полиморфные нуклеотидные последовательности при гибридизации с индивидуальными ДНК, обработанными рестриктазой. Более того, они осознали, что, используя сцепление гена того или иного заболевания с маркерным локусом, можно определить хро- [c.458]
Как получают физические карты Стандартная биохимическая процедура - электрофорез - позволяет (с некоторой точностью ) определить длины рестрикционных фрагментов. однако для построения физической карты требуется также знать порядок расположения этих фрагментов. Так, например, для фага SM Pseudomonas aeruginosa, имеющего всего 3 сайта узнавания рестриктазы HindiII,возможны 24 различных варианта расположения фрагментов, некоторые из них представлены на рис.5.2. В начале 70-х годов возникла идея восстановления порядка расположения фрагментов на физической карте. основанная на использовании данных о совместной рестрикции по двум рестриктазам. [c.155]
Оптимальное планирование Оиохими-ческих экспериментов по картированию. Построение физических карт на ЭВМ освобождает экспериментаторов от рутинной и трудоемкой работы и дает возможность получать подробные физические карты (порядка 10 сайтов по каждой рестрикта-эе), построение которых без помощи ЭВМ невозможно. Однако построение физических карт с 10-20 сайтами по каждой рестриктазе (при использовании только информации об одиночных и совместных рестрикциях) сталкивается с серьезньми вычислительньми трудностями даже на современных ЭВМ. В разделе 5.6 обсуждаются возможности дополнительных биохимических экспериментов, которые позволяют иногда обойти математические проблемы построения физических карт за счет получения (довольно трудоемкого) биохимическими методами информации о порядке расположения рестрикционных фрагментов (при использовании таких методов требования к точности определения длин фрагментов снижаются). Привлечение информации о дополнительных биохимических экспериментах дает возможность строить очень подробные физические карты (20-50 сайтов по каждой рестриктазе). Работа с ЭВМ в режиме диалога позволяет свести к минимуму и экспериментальную работу по картированию - при этом минимизируется количество электрофорезов и указывается минимальный набор дополнительных биохимических экспериментов, необходимых для построения физической карты. [c.161]
Длинные клонированные вставки. входящие в состав X- или космидного вектора. часто бывают весьма неудобными для манипулирования. Поэтому после построения частичной рестрикционной карты вставку можно разделить на более мелкие фрагменты путем субЕлонирования. В принципе субклонирование не отличается от других методов создания рекомбинантных ДНК, просто в этих случаях в качестве исходного генома используют рекомбинантный клон. Для субклонирования обычно применяют рестриктирующие эндонуклеазы. сайты [c.318]
Кроме биологических праймеров, в литературе встречается упоминание о праймерах, как бы синтезируемых самой ДНК-полимеразой в процессе удлинения исходного праймера [Speek et al. 1986]. Данные праймеры представляли собой некий гибрид синтетического универсального праймера (о котором речь пойдет ниже) и биологического. Так, в результате построения второй цепи ДНК Кленовским фрагментом ДНК-полимеразы I с использованием в качестве затравки универсального праймера образовывались двуцепочечные участки ДНК, протяженность которых зависела от времени инкубации. После этого предлагалось, зная рестриктазную карту клонированного фрагмента ДНК, расщеплять вновь построенный двуцепочечный участок соответствующими рестрикционными эндонуклеазами и уже далее проводить непосредственно само секвенирование в виде терминирующих реакций. Следует отметить, что о подобном подходе говорилось и ранее [Godson, 1980], но в силу своей трудоемкости и плохой воспроизводимости он не нашел широкого распространения. [c.60]
Секвенирование больших фрагментов ДНК методом химической деградации по Максаму-Гилберту было возможно путем построения подробной рестриктазной карты клонированного фрагмента ДНК, разработки на ее основе стратегии секвенирования, заключающейся в выборе тех или иных рестриктазных фрагментов исследуемого клона, полностью перекрывающих всю длину вставки (рис. 8.1). Далее следовал этап препаративного расщепления ДНК соответствуюпщми рестрикционными эндонуклеазами. препаративный гель-электрофорез. концевое мечение элюированных фрагментов и проведение реакций химической модификации и гидролиза. Следует отметить, что данный подход к секвенированию крупных вставок методом Максама-Гилберта вполне может быть применен и в настоящее время. однако разработ- [c.234]
Недавно для получения субклонов для секвенирования было предложено использовать рестрикционные эндонуклеазы IIS-типа, причем генерирующие фрагменты ДНК с 5 выступающими нуклеотидами на 5 -конце [Rena, Houslay, 1998]. По мнению авторов. данные уникальные последовательности. образуемые этими 5 нуклеотидами, позволят осуществить правильную состыковку секвенируемых субклонов, не прибегая к построению детальной рестриктазной карты всего фрагмента ДНК. [c.247]
Наиболее оптимальным является получение в составе исходного вектора субклонов, различающихся размером делетированных участков вставки между сайтом какой-либо подходящей полилинкерной рестрикционной эндонуклеазы. предшествующим сайту клонирования (со стороны отжига секвенирующего праймера) и прогрессивно удаляющимися местами вставки. Однако большинство вариантов направленного подхода, предполагающего получение серии таких субклонов, укороченных с одного конца вставки, различаясь значительно при проведении делеционных процедур, требуют первого этапа рестриктазного картирования с целью или построения подробной рестриктазной карты секвенируемого фрагмента ДНК, или обнаружения подходящих рестрикционных эндонуклеаз. отсутствующих во вставке, которые могут быть затем использованы для получения необходимых субклонов. [c.249]
Хотя при осуществлении этого подхода с ДНКазным расщеплением и не требуется построения детальной рестриктазной карты клонированного фрагмента ДНК, все же необходимо владеть информацией об отсутствии сайтов расщепления используемых полилинкерных рестрикционных эндонуклеаз во вставке, поскольку в противном случае результатом будет гетерогенная смесь. в которой будет чрезвычайно трудно разобраться. [c.250]
Еще один уже упоминавшийся выше модуль MapDraw из пакета программ Lasergene рассчитан на поиск в секвенированной последовательности сайтов различных рестрикционных эндонуклеаз. поиск открытых рамок считывания и их трансляцию в белковые продукты. Построение как линейных, так и кольцевых карт сопровождается возможностью добавления большого числа поясняющих символов различных элементов. Важной чертой этого модуля является создание рисунков, пригодных для публикации. [c.343]
Рекомендуем ознакомится: http://chem21.info
